Определение массы вещества по объему. Количество вещества. Молярная масса
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где m A – масса вещества А, а M A – молярная масса вещества А.
Если указан объем газообразного вещества А:
где V A – объем газообразного вещества А, а V m – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
| В общем, последовательность решения таких задач можно изобразить следующей схемой: 1) Зная массу или объем вещества A, рассчитываем его количество вещества. 2) Зная количество вещества A, рассчитываем количество вещества B по формуле: где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами. 3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа: |
Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
где k(Al 2 S 3) и k(H 2 S) – коэффициенты перед Al 2 S 3 и H 2 S соответственно.
Из этого выражения выразим n(Al 2 S 3):
Подставим известные значения n(H 2 S) и коэффициентов перед H 2 S и Al 2 S 3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать .
ЧАСТЬ 1
1. Единицей количества вещества является моль. Обозначается n или ню.
2. Моль — это также количество вещества, в котором содержится молекул или частиц вещества. Это число называется числом Авогадро и обозначается Nа.
3. Чтобы отмерить вещество количеством в 1 моль, нужно взять столько граммов этого вещества, какова его Mr или Ar.
4. Масса 1 моль вещества называется молярной массой — M. Она измеряется в г/моль и численно равна Mr вещества.
5. Количество вещества — это величина, равная отношению массы вещества к его молярной массе:
n = m/M => m = n. M.
6. Число частиц вещества равно произведению числа Авогадро на количество вещества:
N = n .Na => n = N/Na.
7. Дополните таблицу, делая необходимые вычисления.
ЧАСТЬ 2
1. Впишите пропущенные числа.
1) Ar(Na)=23 => 23 г натрия содержат  атомов Na.
2) Мг(02)=32 => 32 г кислорода содержат  молекул 02.
3) Мг (СО) = 28 => 28 г угарного газа содержат  молекул СО.
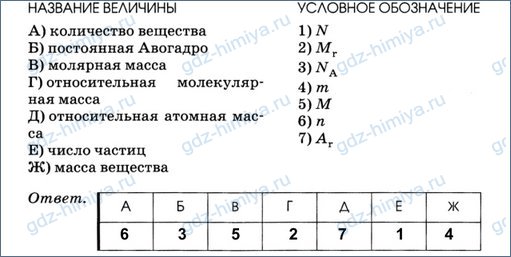
2. Установите соответствие между названием величины и её условным обозначением.
3. Впишите пропущенные названия веществ, частиц вещества, числа и единицы измерения.
1) 1 моль вещества Н2 содержит  молекул.
2)  молекул углекислого газа С02 составляют количество вещества, равное 0,5 моль.
3) 64 г вещества О2 составляют количество вещества, равное 2 моль.
4) 0,5 моль серной кислоты H2S04 составляют массу вещества, равную 49 г.
4. Запишите формулу, по которой можно рассчитать молярную массу вещества, если известно его количество и масса.
5. Запишите формулу, по которой можно рассчитать массу вещества, если известно число структурных частиц данного вещества.
m = N.M/Na
Массу, число частиц.
7. Сколько молекул содержится в 180 г воды? Решите задачу двумя способами.

8. Придумайте условие задачи, используя величины из задания 2. Найти массу воды химическим количеством 10 моль. Решите её любым способом.
Урок по теме:
Расчетные задачи.
Учитель химии
Шлайхер Л.Т.Урок по теме:
Расчетные задачи.
Вычисление молярной массы вещества.
Определение массы вещества по известному количеству вещества и определение количества вещества по известной массе.
Цели урока: закрепить понятия: «количество вещества», «моль», «молярная масса»; показать взаимосвязь массы, количества вещества и числа частиц; научить учащихся решать задачи на нахождение массы вещества, если известно количество вещества и обратная.
Оборудование. дидактический материал (карточки с условиями задач), блок- схем расчетных задач по теме: «Количество вещества. Моль. Молярная масса»
Ход урока
Повторение теоретического материала
Что означает физическая величина «количество вещества»
(определенное число структурных элементов (молекул, атомов, ионов)
Как называется единица измерения количества вещества? (моль)
Как обозначается? (
· или n)
Что показывает число Авогадро? (число частиц в 1 моль вещества)
Как обозначается? (NA)
Чему равно число Авогадро? (6,02·1023)
Как называется масса 1 моль вещества? (молярная масса)
Как ее можно вычислить? (М = Мr)
Подготовка учащихся к решению задач. (приложение 1.)
(ответ:
·, N, NA)
·, М, m)
(m, M,
·)
(m, N, NA)
массу оксида алюминия Al2O3.
(Mr,М,Аr)
(N, NA,
·,m,M)
0,2 моль.
(N, NA,
·)
Запишите условия задач 1,3,6 в кратком виде. Воспроизведите по ним тексты задач (устно).
Задача 1. Задача 3. Задача 6.
Дано: Дано: Дано:
N(Сu) = 1
·(Н2О) = 1,5 моль m(Н2О) = 7,2г
·(Сu) - ? m(Н2О) - ? N(Н2О) - ?
Определите, какие формулы следует использовать для решения задач.
· = N / NA
m =
·M
N =
·NA,
· = m / M
Введите дополнительные данные
NA = 6,02 · 1023
3. M(Н2О) = 18 г/моль
NA = 6,02 · 1023, M(Н2О) = 18 г/моль
Решите данные задачи.
·(Сu) = 1 / 6.02 ·1023 = 0,166моль
3. m(Н2О) = 1,5 моль·18 г/моль = 27г
6.
·(Н2О) = 7,2г / 18г/моль = 0,4 моль; N(Н2О) = 0,4 моль · 6,02 ·1023 =
2,408· 1023
3. Самостоятельное решение задач – метод пошаговой детализации. (блок –
схем расчетных задач) (приложение 2)
В 69г Nа
В 48г Мg
Fe
Другой
250г.
Другой
224г
Другой
2,5 моль
Другой
3,01 · 1024
Другой
Заполнить таблицу. (приложение 3)
Вещество
Формула
Молярная масса, М
Количество вещества,
·
Число частиц, N
Масса,
m
Алюминий
Al
Кислород
O2
3,01 · 1023
Углекислый газ
Закрепление
Рассчитайте количество вещества в образце магния массой 6 г.
Определите число молекул в 0,1 моль брома Вr2
Приложение 1
Определите, какие физические величины следует использовать при решении предложенных задач.
Задача 1. Определите количество вещества, которое составляет 1 атом меди
Задача 2. Определите количество вещества, которое составляет 3,2г меди
Задача 3. Рассчитайте массу воды количеством вещества 1,5 моль.
Задача 4. Рассчитайте массу 6.02 · 1023 атомов углерода, если масса одного атома углерода равна 2,0 · 10-26
Задача 5. Рассчитайте относительную молекулярную массу и молярную
массу оксида алюминия Al2O3.
Задача 6. Определите число молекул воды, если масса воды 7,2г.
Задача 7. Определите число молекул воды, если количество вещества воды
0,2 моль.
Приложение 3
Вещество
Формула
Молярная масса, М
Количество вещества,
·
Число частиц, N
Масса,
m
Алюминий
Al
Кислород
O2
3,01 · 1023
Углекислый газ
Задача 1. (исходная)
Определите, в какой порции вещества содержится больше атомов: в 48г Мg или 69г Nа
Задача 6.
В каком количестве вещества сульфата натрия Nа2SО4 содержится 0,4 моль натрия
Задача 2.
Известно, что в 140г некоторого металла содержат 2,5 моль атомов этого металла. Определите, какой это металл.
Задача 3.
В какой массе железа содержится столько же атомов, сколько их содержится в 256г меди.
Задача 4.
Сравните, в какой порции вещества содержится больше молекул: в 90г воды или в 128г кислорода
Задача 7.
Какую массу имеет 2,5 моль карбоната кальция СаСО3
Задача 8.
Какое количество вещества содержится в 80г кислорода О2
Задача 5.
Какую массу будут иметь 1,806 · 1023 молекул сернистого газа SO2
Отметка « 5 »
Задача 9.
Рассчитайте число молекул, которое содержится в 5 моль углекислого газа СО2
Отметка «4»
Отметка «2»
Отметка «3»
М (Мg) = 24 г/моль
Дано:
m (Мg) = 6г
· (Мg) - ?
NA = 6,02 · 1023
· (Вr2) = 0,1 моль
N (Вr2) - ?
Заголовок 1Заголовок 2Заголовок 315
Приложенные файлы


 Общероссийский народный фронт: как вступить в организацию?
Общероссийский народный фронт: как вступить в организацию? Сеголен Руаяль: фото, биография, личная жизнь, дети
Сеголен Руаяль: фото, биография, личная жизнь, дети Настоящая француженка кристин лагард Кристин лагард биография семья
Настоящая француженка кристин лагард Кристин лагард биография семья Но не из-за нелепых слов в эфире
Но не из-за нелепых слов в эфире